Gttinger
Lebend Test
fr
BSE Risiko
September 2004
Chronix Biomedical, Inc.
1735 N. First Street
Suite 309
San Jose, CA 95112
USA
Tel: +1 408 441 2071
Fax: +1 408 441 7411
Chronix Biomedical, GmbH
Goethealle 8
37073 Gttigen,
Germany
Tel: +49 551 3707 5721
Fax: +49 551 3707 5726
Fr weitere
Informationen, schreiben Sie uns: info@chronix-bio-medical.de
Gttinger
Lebend Test fr BSE Risiko
Name und
Anwendungszweck
Der Gttinger Lebend Test fr BSE Risiko (GLT) ist ein genetischer Test fr
die in vitro Detektion
von Reaktionseigenschaften von aus bovinem Serum isolierten cirkulierenden
Nukleinsuren (CNA). Dieser Test ist zur Durchfhrung in professionellen
Laboratorien ausgelegt und dient als Surrogat Marker bei lebenden Rindern zur
Ermittlung des Risikos BSE zu entwickeln. Rinder die wiederholt eine positive
Reaktion in diesem Test zeigen sollten engmaschig kontrolliert werden, da sie
ein im Vergleich zur Population erhhtes Risiko aufweisen.
Zusammenfassung des Tests
Die Bovine
Spongiforme Enzephalopathie (BSE) ist eine progressive neurodegenerative
Erkrankung bei Rindern. Das Gelangen von Material BSE positiver Rinder in
Nahrungsmittel stellt nach heutigen Erkenntnissen ein Risiko fr den Menschen
dar. Die zurzeit angewendeten Tests fr BSE knnen nur nach Ttung der Tiere
durchgefhrt werden (post mortem) und sind daher fr die Merzung der Erkrankung aus lebenden Herden
unbrauchbar. Der Gttinger Lebend Test fr BSE Risiko ist ein Lebendtest (ante
mortem) zur Erkennung
abnormaler CNA Profile bei Rindern. Abnormale CNA Profile sind Ausdruck einer
Reaktion des Individuums auf Exposition mit krperfremden Agentien, wie z.B.
Toxinen. Die bisher erhobenen Daten deuten darauf hin, dass Rinder mit durch
den GLT erfassten Abweichungen ihres Serum-Nukleinsuren (CNA) Profils ein
signifikant erhhtes Risiko haben, an BSE zu erkranken.
Wegen der noch nicht vollstndig aufgeklrten Pathogenese der BSE und dem
medizinisch anerkannten Risiko der bertragung auf den Menschen, sollten GLT
positive Proben als potenziell infektis behandelt werden, bis weitere
Untersuchungen neue Erkenntnisse erbringen.
Prinzip des GLT
Epidemiologische Anstze zur Kontrolle einer Erkrankung erfordern robuste
Testmethoden, die Individuen mit hohem Risiko identifizieren knnen. Die
transmissiblen spongiformen Enzephalopathien (TSEs) stellen eine Gruppe von
Erkrankungen dar, die durch die Akkumulation eines umgefalteten natrlichen
Proteins, dem Prion Protein gekennzeichnet ist. In seiner natrlich
vorkommenden normal gefalteten Form hat das Prion Protein (PrP) keinen
Krankheitswert, wohingegen die umgefaltete Form die als PrPres
bezeichnet wird mit TSEs assoziiert ist. Der Besttigungstest fr TSEs bestimmt
das Vorhandensein von PrPres im Gehirn post mortem. Da natrliche Antikrper gegen PrPres
kaum gebildet werden, konnte bisher kein Immunoassay gegen solche Antikrper
bei lebenden Tieren (ante mortem) entwickelt werden. Ein anderer epidemiologischer ante mortem Ansatz ist die Messung von cirkulierenden
Nukleinsuren (CNA). CNA sind effektive Marker zur berwachung von Erkrankungen
die mit viralen Gensequenzen assoziiert sind.
Chronix Biomedical hat einen CNA Test entwickelt und validiert, der er
erlaubt, das BSE Erkrankungsrisiko in lebenden Herden abzuschtzen. Der GLT
basiert auf den gleichen Prinzipien, wie viele andere Tests zur berwachung von
viralen Erkrankungen. Es werden Nukleinsurevernderungen in der humuralen
Fraktion des Blutes (Serum oder Plasma) bestimmt. Diese Nukleinsuresequenzen
sind teilweise homolog zu sogenannten repetitiven Sequenzen in Òflanking
regionsÓ, die in vielen Genen – auch dem PrP Gen - zu finden sind. Die CNA werden aus dem Plasma oder Serum extrahiert und
amplifiziert. Die Signalstrke wird mit der von normalen Kontrollproben
verglichen. Proben die wiederholt mehr als fnf Standardabweichungen ber den
Normalkontrollen liegen werden als reaktiv eingeordnet.
Kurzprotokoll
Probengewinnung und Pranalytik
Serum
1.
Blut aus der Schwanzvene oder Schwanzarterie in ein gekennzeichnetes
Serumabnahmegef§ entnehmen.
2.
Das Blut anschlie§end 20-30 Minuten gerinnen lassen.
3.
Danach gekhlt bei 2-8¡C lagern bis zur Zentrifugation.
4.
Das Blut muss innerhalb von 24 Stunden zentrifugiert werden.
5.
Die Zentrifugation soll bei 1000 x g fr 15 Minuten erfolgen.
6. Das Serum wird durch
Pipettierung entnommen und je 0,5 mL in mindestens 2 sterile, gekennzeichnete
1,5 mL z.B. Eppendorfrhrchen berfhrt.
7. Bis zur weiteren Verwendung muss das Serum
bei mindestens -20¡C gefroren werden.
Plasma
1.
Blut aus der Schwanzvene oder Schwanzarterie in ein gekennzeichnetes
Abnahmegef§ (EDTA oder Citrat) entnehmen.
2.
Danach gekhlt bei 2-8¡C lagern bis zur Zentrifugation
3.
Das Blut muss innerhalb von 24 Stunden zentrifugiert werden.
4.
Die Zentrifugation soll bei 1000 x g fr 15 Minuten erfolgen.
5. Das Plasma wird durch
Pipettierung entnommen und je 0,5 mL in mindestens 2 sterile, gekennzeichnete
1,5 mL z.B. Eppendorfrhrchen berfhrt
6. Bis zur weiteren Verwendung muss das
Plasma bei mindestens -20¡C gefroren werden
Testdurchfhrung
1.
Auftauen der Serumprobe
2.
Zentrifugation zur Anreicherung der Mikrovesikel
3.
Extraktion der SNA
(Extrahierte Nukleinsuren knnen bis zur Verwendung bei -80¡C eingefroren
werden)
4.
PCR mit geeignetem dsDNA Farbstoff durchfhren
5.
Aufnehmen der Schmelzkurven im diagnostischen Temperaturfenster.
6.
Berechnung des Ergebnisses anhand der AUC
7.
Interpretation
der Ergebnisse
Nicht Reaktive Proben
á Eine Probe ist nicht reaktiv, wenn das
Signal die 5SD Grenze der Normalkontrollen nicht bersteigt.
á Eine nicht reaktive Probe wird als im
Vergleich zu Normalen als unauffllig betrachtet. (zeigt das gleiche CNA Profil wie die gesunden
Vergleichsproben
á Rinder mit nicht reaktiven CNA zeigen kein
messbar erhhtes BSE Risiko zum Zeitpunkt der Probengewinnung.
Reaktive
Proben
á Eine Probe wird als reaktiv betrachtet,
wenn zwei Aliquots ein messbar ber der 5SD Grenze liegendes Ergebnis zeigen.
á Rinder mit wiederholt reaktivem Ergebnis
werden als Tiere mit erhhtem BSE Risko eingestuft.
Test Ergebnisse der bisherigen Studien:
Untersuchungen
an BSE Kohorten:
Die EU definiert Kohorten als Tiere, die innerhalb von 12 Monaten um die
Geburt eines BSE erkrankten Tieres auf demselben Hof geboren wurden oder
aufgewachsen sind. Statistisch haben solche Tiere, nach den Erhebungen des
BMVEL ein ca. 100-fach erhhtes Risiko an BSE erkrankt zu sein als die
Gesamtpopulation. Dieses Risiko begrndet sich auf die Tatsache, dass alle
Tiere einer Kohorte, dem gleichen BSE-kontaminierten Futter ausgesetzt worden
sind, wie das an BSE erkrankte Rind
![]()
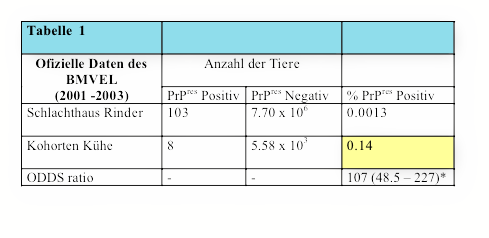
Tabelle 1 zeigt, dass die
Wahrscheinlichkeit PrPres positiv an BSE erkrankt zu sein in
Kohorten ber 100-fach hher ist als in normal geschlachteten Rindern die nicht
von Kohorten stammen
Um zu untersuchen, ob dieses mehr als 100-fach erhhte BSE Risiko mit
Vernderungen im GLT einhergeht wurden fnfzehn individuelle BSE Kohorten
untersucht. Aus den Ergebnissen (Figure 1) wird erkenntlich, dass mindestens
33% der Rinder in einer Kohorte ein positives GLT Ergebnis zeigen. Zustzlich
zeigten
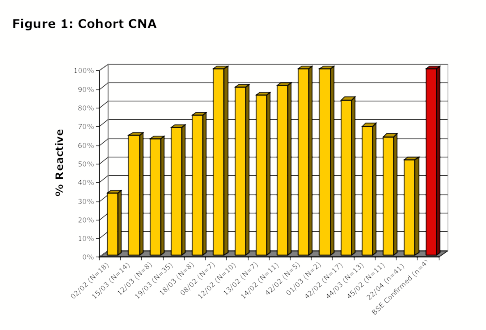 vier von vier getesteten PrPres
positiven BSE Rindern ein positives GLT Ergebnis. Die Ergebnisse sind im
Vergleich zu normal geschlachteten Kontrollrindern hoch signifikant
(p<0.001).
vier von vier getesteten PrPres
positiven BSE Rindern ein positives GLT Ergebnis. Die Ergebnisse sind im
Vergleich zu normal geschlachteten Kontrollrindern hoch signifikant
(p<0.001).
Normalkollektiv
908 Serumproben von besttigt PrPres –negativen Rindern
wurden in einem Schlachthaus entnommen und wie oben beschrieben im GLT
getestet. Tabelle 2 zeigt die Anzahl der getesteten Tiere und die Rate
positiver Ergebnisse. Alle eingeschlossenen Rinder sind mit einem zugelassenen
Schnelltest auf PrPres im Hirnstamm untersucht worden und waren
negativ. In jedem Testlauf wurden Extraktionskontrollen,
Amplifikations–kontrollen, negative Kontrollseren und Leerkontrollen
mitgefhrt. Zustzlich wurde ein Panel von bekannten Kohortenproben vermessen
(23 positive und 12 negative). Die Proben wurden
|
Tabelle 2 |
|
|
|
|
Test Population |
N |
RR |
%RR |
|
Schlachthaus Rinder |
908 |
5 |
0.55 |
|
Kohorten Kontrollen |
35 |
23 |
65.7 |
![]() verblindet
im GLT getestet, die Ergebnisse ermittelt und am Ende eines jeden Testtages
entblindet. Ergebnisse wurden akzeptiert, wenn die Kontrollen richtig erfasst
wurden. Die Ergebnisse dieser Studie sind in Tabelle 2 wiedergegeben.
verblindet
im GLT getestet, die Ergebnisse ermittelt und am Ende eines jeden Testtages
entblindet. Ergebnisse wurden akzeptiert, wenn die Kontrollen richtig erfasst
wurden. Die Ergebnisse dieser Studie sind in Tabelle 2 wiedergegeben.
berblick der Ergebnisse
Die bisherigen Studien wurden an 908 normalen, PrPres negativen
Rindern, 4 besttigten BSE Rindern und 207 Hoch-Risiko Kohorten Rindern
durchgefhrt.
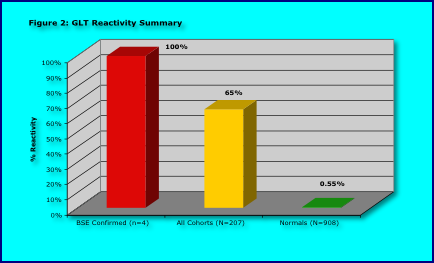 Die Gesamtergebnisse (Figure 2) zeigen, dass
BSE Kohorten eine ca. 100-fach hhere GLT Reaktivitt haben als normal
geschlachtete nicht an BSE erkrankte Rinder.
Die Gesamtergebnisse (Figure 2) zeigen, dass
BSE Kohorten eine ca. 100-fach hhere GLT Reaktivitt haben als normal
geschlachtete nicht an BSE erkrankte Rinder.
Schlussfolgerung
Die Ergebnisse der Studien mit dem GLT, wie sie in
Figure 2 gezeigt sind, erlauben den Schluss, dass:
1. 65% von Hoch-Risiko BSE Kohorten Rindern (n=207) und vier von 4 BSE Rindern
(100%) ein wiederholt reaktives Ergebnis zeigen.
2. nur 0.55% von gesund geschlachteten, PrPres negativen Rindern
(n=908) in Deutschland eine GLT Reaktivitt zeigen.
Rinder, die eine wiederholt positive Reaktion im GLT zeigen, sollten als
Tiere betrachtet werden, die ein erhhtes Risiko einer bereits stattgefundenen
PrPres Exposition aufweisen und somit ein erhhtes Risiko BSE zu
entwickeln in sich tragen.
Anmerkungen
Die hier
gezeigten Studien wurden im Tierrztlichen Institut der Universitt Gttingen
unter der Leitung von Prof. Dr. Dr. Bertram Brenig durchgefhrt.
Der GLT Test ist kein
zugelassener Test zur Diagnostik von BSE. Der Anwendungszweck ist vielmehr fr
epidemiologische Untersuchungen im Sinne einer Risikoabschtzung.
Die gezeigten Daten sind
zurzeit in Begutachtung zur Publikation in wissenschaftlichen Zeitschriften
eingereicht.
Material und
Methoden
Serum Proben. Blut
wurde aus der Schwanzvene oder der Schwanzarterie von Rindern in 18 mL
Kunststoffrhrchen, die mit Gerinnungsaktivatoren beschichtet waren entnommen.
Diese wurden fr 30 min. bei Raumtemperatur bis zum Eintritt der Gerinnung und
danach bei 4 bis 8¼C gelagert. Die Zentrifugation erfolgte innerhalb von 24
Stunden bei 1000 x g fr 15 min. Der Serumberstand wurde sofort in 1.5mL
Rhrchen berfhrt und eingefroren (bei –20 ¡C oder -80 ¡C).
Plasma Proben. Analog
der Serum Entnahme kann eine Plasma Gewinnung in EDTA oder Citrat
antikoagulierter Form erfolgen. Heparinat-Rhrchen sind ungeeignet. Die weitere
Verarbeitung ist wie unter ÒSerumÓ beschrieben, wobei eine 30 mintige
Aufbewahrung des Blutes bei Raumtemperatur entfallen kann.
Proben Prparation. Eingefrorene Seren wurden bei 4¼C aufgetaut. 250 µl wurden bei 20,000 x g
fr 30 min. bei 4 ¡C in einer Modell 5214 Zentrifuge (Eppendorf, Hamburg,
Germany) zentrifugiert. Der berstand wurde verworfen und das Pellet fr die
weitere Verarbeitung verwendet.
Nukleinsure Extraktion. 20,000 x g Pellets wurden mit einem Standardverfahren zur Extraktion nach
Vorschrift des Herstellers verwendet (NucleoMag; Macherey & Nagel, Dren,
Germany). Die Nukleinsure Extrakte wurden bei -80¼C bis zur weiteren Verwendung
eingefroren.
Diagnostische PCR. Drei µL der wie oben beschrieben
extrahierten CNA wurden in einer PCR mit einem Gesamtvolumen von 20µL
verwendet. Die Primer CHX-1F and CHX-1R (Cat#: 42-4103 und 42-91102, Chronix
Biomedical GmbH, Gttingen, Germany), wurden mit 1 µM in einem ÒproofreadingÓ
Polymerase System (Advantage-2 PCR Kit, BD-Clontech, Heidelberg, Germany)
eingesetzt. Nach 30 Zyklen (95 ¡C fr 30 sec, 55
¡C fr 45 sec, 68 ¡C fr 1 min) wurde
mit Hilfe von SybrGreenI (Cat#: S7563, Molecular Probes, Eugene, OR, USA) eine
Schmelzkurve in einem MX4000 PCR System aufgenommen (Cat#: 401260, Stratagene,
La Jolla, CA, USA). Die Flche unter der Kurve (area under the curve; AUC) der
abgeleiteten Fluoreszenzfunktion –d(F)/dT zwischen 87 ¡C und 90 ¡C wurde zur
Analyse herangezogen. Die Reaktivitt jeder individuellen Probe wurde auf der
Basis der mit 5SD definierten unteren Messgrenze ermittelt.
Statistik. Die statistische Signifikanz der Differenz in der
Reaktivitt zwischen normalen Rindern und Kohortentieren wurde mittels des Chi2-Tests
ermittelt. Die Anzahl der Freiheitsgrade wurde der Anzahl der getesteten
Gruppen jeweils angepasst.
Literatur
1. Taback, B. and D. S. Hoon. Circulating nucleic acids in plasma and serum: past, present and future. Curr Opin Mol Ther. 6(3):273-278, 2004.
2. Durie, B.G.M., H.B. Urnovitz and W.H. Murphy. RNA in the Plasma of Multiple Myeloma Patients: Clinical Relevance and Molecular Pathology. Acta Oncologica. 39: 789-796, 2000.
3. Urnovitz, H.B., J.J. Tuite, J.M. Higashida and W.H. Murphy. RNA in the Serum of Persian Gulf War Veterans Has Segments Homologous to Chromosome 22q11.2. Clin Diag Lab Immunol. 6:330-335, 1999.
4. Brenig B, E. Schtz, und H.B. Urnovitz. Zellulre Nukleinsuren in Serum und Plasma als neue Diagnostische Werkzeuge. Berl. Mnch. Tierrztl. Wochenschr. 115: 122-4, 2002
5.
BMVEL [Zahl
der durchgefhrten BSE-Tests im Berichtszeitraum] (2003).